Behandling af artritis urica
Artikel fra Rationel Farmakoterapi 9, 2018
Månedsbladene opdateres ikke efter udgivelsen. Indholdet afspejler den aktuelle evidens på udgivelsestidspunktet.
- Tonny Studsgaard Petersen: Klinisk Farmakologisk Afdeling, Bispebjerg og Frederiksberg Hospitaler
- Ole Slot: Videncenter for Reumatologi og Rygsygdomme, Rigshospitalet
Artritis urica er den hyppigste inflammatoriske ledlidelse og forekommer i befolkningen med en prævalens på 2% [1]. Sygdommen optræder oftere hos mænd, og forekomsten stiger med alderen. Sygdommen skyldes udfældninger af uratkrystaller i og omkring leddene, hvilket fremprovokerer en immunologisk reaktion. Efter længere tids sygdom kan udfældningerne dan- ne karakteristiske subkutane knuder (tofi) i bindevævet. Baggrunden for uratudfældningerne er hyperurikæmi, hvor plasmaurat (p-urat)-niveauet overstiger den fysiologiske mætningskoncentration på 0,41 mmol/l [2]. Selv efter sænkning af p-urat under denne grænse kan der forekomme anfald, da ligevægten indstiller sig langsomt mellem væv og plasma. Langt den hyppigste årsag til hyperurikæmi er nedsat renal udskillelse af urat, hvilket kan være konstitutionelt og arveligt betinget eller skyldes behandling med loop- eller thiaziddiuretika [3]. Hyperurikæmi er foruden nedsat nyrefunktion associeret til det metaboliske syndrom og optræder derfor ofte samtidig med diabetes, overvægt, hypertension og iskæmisk hjertesygdom. Derfor bør patienterne også evalueres for kardiovaskulære risikofaktorer og rådgives om livsstilændringer og eventuelt behandles i relation til dette [4].
Asymptomatisk hyperurikæmi er væsentligt hyppigere end artritis urica og kræver som udgangspunkt ikke behandling [5].
Diagnostik og differentialdiagnoser
Klinisk kan diagnosen stilles med nogenlunde sikkerhed hos patienter, der har akut (eventuelt recidiverende) monoartritis i 1. MTP-led (podagra) eller mellemfod/ankel med svære smerter, hævelse og rødme, der udvikler sig over 6-12 timer og varer i op til 6-8 dage ledsaget af forhøjet p-uratniveau.
Det kliniske billede kan dog variere, og en sikker diagnose kræver påvisning af uratkrystaller i ledvæske eller i tofusmateriale. Ved tvivlstilfælde bør patienterne henvises til reumatologisk udredning og ledpunktur. Ultralydskanning er en ny modalitet, som kan bruges til at støtte diagnosen ved at påvise urataflejringer i og omkring leddene [6].
Relevante differentialdiagnoser til artritis urica er andre krystaludløste artritter (specielt pyrofosfat), erysipelas, dyb venetrombose, osteoartrose, fraktur eller septisk artritis [4].
Behandlingen af artritis urica
Behandlingen af artritis urica består af
• Anfaldsbehandling, som er symptomatisk smertedæmpende, og anti-inflammatorisk behandling
• Uratsænkende behandling, som på sigt vil være kurativ
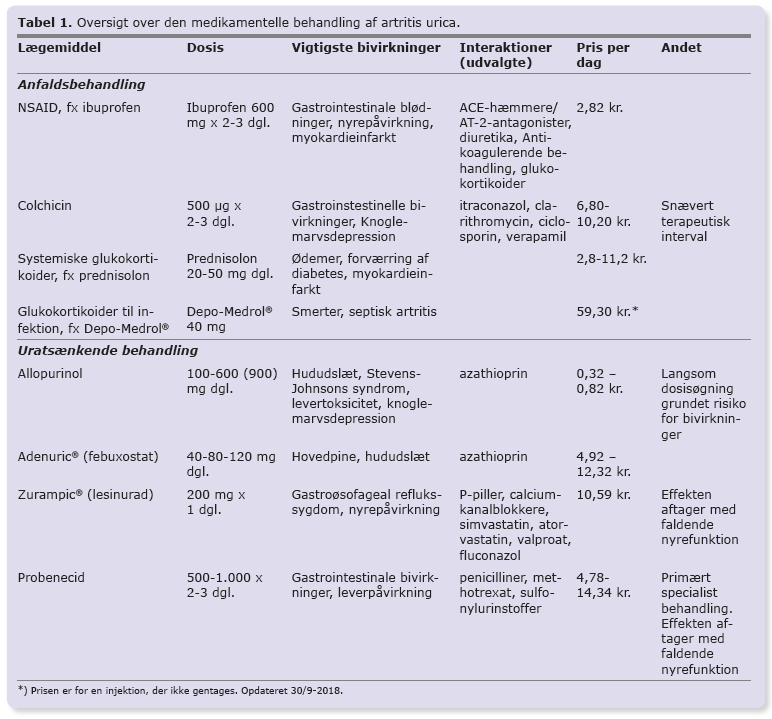
De forskellige præparater til medikamentel behandling af artritis urica er opsummeret i Tabel 1.
Farmakologisk behandling
Anfaldsbehandling
NSAID
NSAID er førstevalg til akutte anfald trods relativ sparsom evidens for effekt [7, 8]. NSAID-behandling giver øget risiko for gastrointestinale blødninger, nyrepåvirkning og myokardieinfarkter, hvorfor der bør udvises forsigtighed ved behandling af risikogrupper for disse hændelser, dvs. patienter med manifest hjerte-kar-sygdom, patienter i AK-behandling, og patienter med kronisk nyreinsufficiens. NSAID er kontraindiceret hos patienter med pågående blødning, recidiverende ulcus, svær hjerteinsufficiens, svær leverinsufficiens og svær nyreinsufficiens. Eksempelvis kan tablet ibuprofen 400-600 mg x 3 dagligt anvendes ved anfald.
Colchicin
Colchicin hæmmer leukocytfunktionen og virker antiinflammatorisk. Colchicin har et relativt snævert terapeutisk vindue og bør anvendes med forsigtighed ved nedsat nyrefunktion og er kontraindiceret ved svært nedsat nyre- eller leverfunktion. Man bør også være opmærksom på lægemiddelinteraktioner (Tabel 1). Colchicin kan også anvendes som anfaldsprofylaktisk behandling i forbindelse med iværksættelse af uratsænkende behandling, som fx allopurinol eller febuxostat (Adenuric®). Colchicin ser ikke ud til at øge risikoen for myokardieinfarkt og kan med fordel anvendes i stedet for NSAID hos risikopatienter [9].
Colrefuz® (colchicin) blev anmeldt af IRF i 2016 [10]. Siden da har lægemidlet fået generelt tilskud og blevet tilgængeligt i en pakningsstørrelse på 20 stk., hvilket svarer til forbruget ved anfald. Til anfaldsprofylaktisk behandling i forbindelse med iværksættelse af uratsænkende behandling anbefales colchicin 0,5 mg x 2 i 3-6 mdr. Her er en pakningsstørrelse på 100 stk. egnet.
Glukokortikoider
Glukokortikoider kan både anvendes systemisk og som lokalinjektioner i afficerede led ved anfald. Typisk dosis ved anfald er 25-50 mg prednisolon dagligt i 3-5 dage [4]. Ved korttidsbehandling er risikoen for bivirkninger væsentlig mindre end ved kronisk behandling. Effekten af behandlingen er sammenlignelig med effekten af NSAID og muligvis forbundet med færre bivirkninger [7]. Ligesom NSAID er glukokortikoidbehandling forbundet med øget risiko for kardiovaskulære hændelser og gastrointestinale blødninger, om end risikoen for sidstnævnte ser ud til at være lavere end ved NSAID-behandling [11, 12].
Et alternativ til systemisk behandling er lokal injektion af 1-2 ml depotsteroid. Der er ingen klinisk kontrollerede studier, der har undersøgt effekten i artritis urica, og evidensen er primært baseret på klinisk erfaring og ekstrapolation fra andre inflammatoriske ledlidelser [13].
Uratsænkende behandling
Formålet med uratsænkende behandling er nedsættelse af vævskoncentrationen af urat til under mætningskoncentrationen, således at krystallisering forhindres, og aflejret urat opløses og udskilles. Derved bliver patienten kureret for sin artritis urica, så længe behandlingen fortsættes. Behandlingsmålet er p-urat under 0,36 mmol/l ved ukompliceret artritis urica og under 0,30 mmol/l ved toføs artritis. Således bør behandlingen baseres på gentagne målinger af p-urat og justering af behandlingen, indtil behandlingsmålet er nået [4]. Afhængigt af sværhedsgraden af sygdommen kan det tage op til flere år, inden aflejret urat i tofi er opløst, og anfaldsrisikoen helt minimeret [14, 15].
Der er indikation for uratsænkende behandling ved klinisk artritis urica og forhøjet p-uratniveau (> 0,41 mmol/l) [4]. Asymptomatisk forhøjet uratniveau er ikke en behandlingsindikation.
P-urat kan sænkes ved nedsættelse af produktionen af urat gennem hæmning af xantin-oxidasen og/eller ved at øge den renale udskillelse med urikosuriske lægemidler.
Ved initiering af den uratsænkende behandling ses ofte en øgning i anfaldsfrekvensen på grund af destabilisering af urataflejringerne. Man kan modvirke øgningen i anfaldsfrekvens ved at påbegynde lavdosis-colchicinbehandling profylaktisk det første halve år – eller længere ved svær sygdom. Akutte anfald medfører ofte problemer med komplians til behandlingen [4]. Derfor er anfaldsprofylakse, anfaldsbehandling og patientinformation essentielle faktorer sammen med målrettet uratsænkende behandling, hvis målet om helbredelse skal nås. Når en uratsænkende behandling er iværksat, skal man ikke holde pause, selv om patienten oplever et anfald, dette ville medføre en ”stop and go”-behandling, hvor behandlingsmålet vil være svært at nå.
Den uratsænkende behandling er principielt livslang, men ligesom det også ses ved diabetes, kan vægttab og livsstilændringer medføre, at den medikamentelle behandling kan justeres eller (sjældent) ophøre.
Xantinoxidasehæmmere
Xantinoxidasehæmmerne reducerer p-uratniveauet ved at hæmme omdannelsen af hypoxantin til urat. Hypoxantin er mere vandopløseligt end urat og udskilles renalt. Effekten er uafhængig af nyrefunktionen. Febuxostat og allopurinol er aktuelt de to eneste markedsførte xantinoxidasehæmmere i Danmark.
Allopurinol
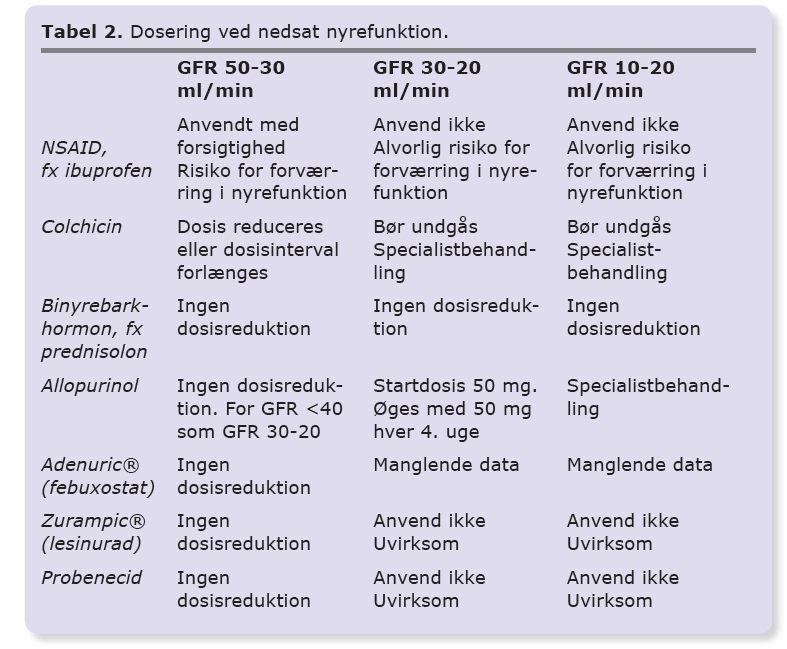
Allopurinol er førstevalget til langt de fleste patienter. Allopurinol metaboliseres hurtigt til den aktive metabolit oxypurinol, der udskilles i nyrerne. Startdosis af allopurinol er 100 mg dagligt for patienter med normal nyrefunktion og 50 mg for patienter med nedsat nyrefunktion (eGFR 20-40 ml/min) [16, 17]. Dosis øges hver 2.-4. uge med 50-100 mg (startdosis) til p-uratniveauet er faldet til det ønskede niveau eller til dosisbegrænsende bivirkninger. En dosisøgning på 100 mg giver et gennemsnitlig fald i p-urat på 0,07 mmol/l [18]. Den gennemsnitlige nødvendige dosis for at nå behandlingsmålet er 300-450 mg dagligt. Næsten halvdelen af patienterne har behov for mere end 300 mg dagligt [4, 17, 19-21]. Sædvanlig maksimaldosis er 600 mg. Kun sjældent er der behov for at gå op til 900 mg i døgnet, hvilket vil være en specialistopgave, ligesom behandling ved svær nyreinsufficiens også er en specialistopgave. Ved faldende nyrefunktion kan dosisreduktion være nødvendig under hensyntagen til, at patienten holder behandlingsmålet [22].
Ved gastrointestinale bivirkninger kan man dele dosis ud på 2-3 daglige doseringer. Hududslæt og kløe forekommer hos ca. 5% og bør give anledning til pause og evt. præparatskift. Patienterne bør informeres om dette. Meget sjældent ses udvikling af et overfølsomhedssyndrom i form af svære kutane bivirkninger (DRESS eller Stevens-Johnsons syndrom/toksisk epidermal nekrolyse) i løbet af de første 1-3 måneder af behandlingen [23]. Risikofaktorer for udviklingen af denne alvorlige bivirkning er nyreinsufficiens, høj startdosis, asymptomatisk hyperurikæmi, og tilstedeværelsen af HLA-B5801-vævstypen, som ses hyppigt hos asiater og afrikanere [23-25]. Det er aktuelt ingen laboratorier i Danmark, der udbyder målinger af HLA-B5801.
Febuxostat (Adenuric®)
Febuxostat adskiller sig fra allopurinol ved ikke at blive udskilt i nyrerne og af en lavere hyppighed af kutane bivirkninger. Adenuric® er noget dyrere end allopurinol og har ikke generelt tilskud, men kan anvendes hos patienter, der ikke tåler allopurinol og hos patienter med GFR ned til 30 ml/min. 80 mg febuxostat er ækvipotent med 400 mg allopurinol. Startdosis af febuxosat bør derfor være 40 mg (halv tablet) dagligt, hvilket efter fire uger kan øges til 80 mg dagligt. Ved behov kan dosis øges til 120 mg for at opnå behandlingsmålet [26]. 80 mg febuxostat giver et gennemsnitlig fald på 0,27 mmol/l og 120 mg et fald på ca. 0,31 mmol/l [26]. Nylige undersøgelser har påvist en let forøget kardiovaskulær dødelighed ved behandling med febuxostat i forhold til allopurinol hos patienter med kardiovaskulær sygdom, svarende til et number needed to harm (NNH) på 92 for 32 måneders behandling [27]. Det bør derfor anvendes med forsigtighed til patienter med iskæmisk hjertesygdom eller hjertesvigt. Adenuric® blev anmeldt af IRF i april 2014 [28].
Urikosuriske lægemidler
Denne gruppe af lægemidler virker ved at hæmme tilbageresorptionen af urat i nyretubuli, hvorved udskillelsen af urat i urinen stiger. Hos hovedparten (85-90%) af patienter med forhøjet p-uratniveau skyldes dette en nedsat udskillelse af urat. Det er primært denne gruppe, der har gavn af behandlingen. Ved måling af døgnudskillesen af urat i urinen er det muligt at undersøge, om der er tale om nedsat udskillelse eller forøget produktion. Effekten af disse lægemidler aftager med nyrefunktionen, og der er stort set ingen effekt ved GFR < 30 ml/min [29]. Patienterne anbefales at indtage rigeligt væske under behandlingen for at reducere risikoen for nyresten, ligesom alkaliseringen af urinen kan overvejes, specielt hos patienter med tidligere nyresten. Udover probenecid og lesinurad (Zurampic®) har flere lægemidler en mindre urikosurisk virkning herunder losartan (angiotensin II-receptorantagonist) [30]. Sidstnævnte kan derfor med fordel anvendes som antihypertensiv behandling hos patienter med artritis urica. Samme effekt ses ikke ved de øvrige angiotensin II-receptorantagonister eller ved ACE-hæmmere.
Probenecid
Probenecid er et af de ældste lægemidler mod artritis urica. Dets korte halveringstid betyder, at probenecid skal doseres mindst to gange dagligt [31]. Grundet hæmningen af diverse transportører i nyrerne har probenecid flere interaktioner (Tabel 1). Probenecid som monoterapi i en dosis på 2 g dagligt giver et fald i p-uratniveauet på ca. 0,25 mmol/l ved normal nyrefunktion [32]. Behandling med probenecid kan kombineres med allopurinol [33]. Grundet den udtalte urikosuriske virkning optitreres dosis langsomt for at forebygge nyresten. I Danmark anvendes probenecid sjældent og da primært af reumatologer. Traditionelt anbefales alkanisering af urinen, om end nødvendigheden af dette er omdiskuteret [33].
Zurampic® (lesinurad)
Zurampic® er et relativt nyt lægemiddel, markedsført i Danmark i januar 2018. Zurampic® er kun godkendt som tillæg til behandling med allopurinol eller febuxostat, da monoterapi er forbundet med flere bivirkninger. Dosis er 200 mg x 1 dagligt. Behandlingen med lesinurad giver gennemsnitligt en reduktion i p-uratniveauet på 0,07 mmol/l [34, 35]. Under behandlingen er der en øget risiko for påvirkning af nyrefunktionen, som derfor skal følges nøje, ligesom sufficient væskeindtag skal sikres. Lesinurad er en mere selektiv hæmmer af urattransportproteinerne i nyrerne end probenecid, men inducerer CYP3A4 i let til moderat grad. Det har derfor andre lægemiddelinteraktioner end probenecid, og skal kun doseres 1 x dagligt. Behandling med lesinurad kan overvejes hos patienter, som ikke er kommet under målet på 0,36 mmol/l p-urat trods maksimal tolerabel dosis af allopurinol/febuxostat. Effekten af lesinurad er beskeden sammenlignet med probenecid. I den godkendte dosering er bivirkningsfrekvensen lav, særligt hos patienter med normal til let nedsat nyrefunktion. Præparatet vil derfor kunne anvendes i almen praksis.
Nonfarmakologisk behandling
Der er relativ sparsom evidens for nonfarmakologisk behandling af artritis urica. Bedst dokumenteret er vægttab, som er forbundet med fald i p-uratniveauet [36].
En kost rig på frugt, grønsager og fedtfattige mejeriprodukter og med et reduceret indtag af fedt og mættet fedt gav sammenlignet med en typisk amerikansk diæt anledning til et fald i p-urat på 15% hos personer med forhøjet p-uratniveau (> 0,36 mmol/l). Lignende effekter er observeret ved omlægning af kosten til mere langsom optagelige kulhydrater (lavt glykæmisk index) [37]. Et øget indtag af kød er forbundet med en øget risiko for at udvikle artritis urica [38].
Højt indtag af alkohol, specielt i form af øl, er forbundet med en øget risiko for artritis urica. Et lavt dagligt forbrug af alkohol op til gennemsnitlig to genstande dagligt er ikke forbundet med øget risiko [39].
Referencer
1. Dehlin M, Drivelegka P, Sigurdardottir V et al. Incidence and prevalence of gout in Western Sweden. Arthritis Res Ther 2016;18:164.
2. Martillo MA, Nazzal L, Crittenden DB. The crystallization of monosodium urate. Curr Rheumatol Rep 2014;16:400.
3. Choi HK, Atkinson K, Karlson EW et al. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow-up study. Arch Intern Med 2005;165:742-8.
4. Artritis urica – Klinisk retningslinje. Dansk Reumatologisk Selskab. http://www.danskreumatologiskselskab.dk/index.php?id=103 (10. jun 2018).
5. Kapetanovic MC, Nilsson P, Turesson C et al. The risk of clinically diagnosed gout by serum urate levels: results from 30 years follow-up of the Malmö Preventive Project cohort in southern Sweden. Arthritis Res Ther 2018;20:190.
6. Ogdie A, Taylor WJ, Neogi T et al. Performance of ultrasound in the diagnosis of gout in a multicenter study: comparison with monosodium urate monohydrate crystal analysis as the gold standard: performance of ultrasound in the diagnosis of gout. Arthritis Rheumatol 2017;69:429-38.
7. Wechalekar MD, Vinik O, Moi JHY et al. The efficacy and safety of treatments for acute gout: results from a series of systematic literature reviews including cochrane reviews on intraarticular glucocorticoids, colchicine, nonsteroidal antiinflammatory drugs, and interleukin-1 inhibitors. J Rheumatol Suppl 2014;92:15-25.
8. van Durme CM, Wechalekar MD, Buchbinder R et al. Non-steroidal anti-inflammatory drugs for acute gout. Cochrane Database Syst Rev 2014;9:CD010120.
9. Hemkens LG, Ewald H, Gloy VL et al. Cardiovascular effects and safety of long-term colchicine treatment: Cochrane review and meta-analysis. Heart 2016;102:590-6.
10. Colrefuz® (colchicin). https://www.sst.dk/da/rationel-farmakoterapi/praeparatanmeldelser/colrefuz-colchicin (13. jun 2018).
11. Varas-Lorenzo C, Rodriguez LAG, Maguire A et al. Use of oral corticosteroids and the risk of acute myocardial infarction. Atherosclerosis 2007;192:376-83.
12. Reinau D, Schwenkglenks M, Früh M et al. Glucocorticoids and the risk of peptic ulcer bleeding: case–control analysis based on swiss claims data. Drug Saf 2018;41:725-30.
13. Wechalekar MD, Vinik O, Schlesinger N et al. Intra-articular glucocorticoids for acute gout. Cochrane Database Syst Rev 2013;4:CD009920.
14. Becker MA, Schumacher HR, MacDonald PA et al. Clinical efficacy and safety of successful longterm urate lowering with febuxostat or allopurinol in subjects with gout. J Rheumatol 2009;36:1273-82.
15. Schumacher HR, Becker MA, Lloyd E et al. Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. Rheumatology 2008;48:188-94.
16. Produktresumé Allopurinol “TEVA”. http://www.produktresume.dk (12. jun 2018).
17. Stamp LK, Taylor WJ, Jones PB et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol. Arthritis Rheum 2012;64:2529-36.
18. Jennings CG, Mackenzie IS, Flynn R et al. Up-titration of allopurinol in patients with gout. Semin Arthritis Rheum 2014;44:25-30.
19. Stamp LK, O’Donnell JL, Zhang M et al. Using allopurinol above the dose based on creatinine clearance is effective and safe in patients with chronic gout, including those with renal impairment. Arthritis Rheum 2011;63:412-21.
20. Stamp LK, Chapman PT, Barclay M et al. Allopurinol dose escalation to achieve serum urate below 6 mg/dL: an open-label extension study. Ann Rheum Dis 2017;76:2065-70.
21. Stamp LK, Chapman PT, Barclay ML et al. A randomised controlled trial of the efficacy and safety of allopurinol dose escalation to achieve target serum urate in people with gout. Ann Rheum Dis 2017;76:1522-8.
22. Wright DFB, Stamp LK, Merriman TR et al. The population pharmacokinetics of allopurinol and oxypurinol in patients with gout. Eur J Clin Pharmacol 2013;69:1411-21.
23. Ramasamy SN, Korb-Wells CS, Kannangara DRW et al. Allopurinol hypersensitivity: a systematic review of all published cases, 1950–2012. Drug Saf 2013;36:953-80.
24. Yang CY, Chen CH, Deng ST et al. Allopurinol use and risk of fatal hypersensitivity reactions: a nationwide population-based study in Taiwan. JAMA Intern Med 2015;175:1550-7.
25. Yu KH, Yu CY, Fang YF. Diagnostic utility of HLA-B5801 screening in severe allopurinol hypersensitivity syndrome: an updated systematic review and meta-analysis. Int J Rheum Dis 2017;20:1057-71.
26. EMA. Produktresume ADENURIC. https://www.ema.europa.eu/documents/product-information/adenuric-epar-product-information_da.pdf
27. White WB, Saag KG, Becker MA et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout. N Engl J Med 2018;378:1200-10.
28. Adenuric (febuxostat). https://www.sst.dk/da/rationel-farmakoterapi/praeparatanmeldelser/adenuric_febuxostat (6. aug 2018).
29. Gillen M, Valdez S, Zhou D et al. Effects of renal function on pharmacokinetics and pharmacodynamics of lesinurad in adult volunteers. Drug Des Devel Ther 2016;10:3555-62.
30. Shahinfar S, Simpson RL, Carides AD et al. Safety of losartan in hypertensive patients with thiazide-induced hyperuricemia. Kidney Int 1999;56:1879-85.
31. Produktresume Probenecid “Medic”. http://www.produktresume.dk (13. jun 2018).
32. Reinders MK, Roon EN van, Jansen TLTA et al. Efficacy and tolerability of urate-lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol. Ann Rheum Dis 2009;68:51-6.
33. Pui K, Gow PJ, Dalbeth N. Efficacy and tolerability of probenecid as urate-lowering therapy in gout; clinical experience in high-prevalence population. J Rheumatol 2013;40:872-6.
34. Bardin T, Keenan RT, Khanna PP et al. Lesinurad in combination with allopurinol: a randomised, double-blind, placebo-controlled study in patients with gout with inadequate response to standard of care (the multinational CLEAR 2 study). Ann Rheum Dis 2017;76:811-20.
35. Saag KG, Fitz-Patrick D, Kopicko J et al. Lesinurad combined with allopurinol: a randomized, double-blind, placebo-controlled study in gout patients with an inadequate response to standard-of-care allopurinol (a US-based study). Arthritis Rheumatol 2017;69:203-12.
36. Nielsen SM, Bartels EM, Henriksen M et al. Weight loss for overweight and obese individuals with gout: a systematic review of longitudinal studies. Ann Rheum Dis 2017;76:1870-82.
37. Juraschek SP, McAdams-Demarco M, Gelber AC et al. Effects of lowering glycemic index of dietary carbohydrate on plasma uric acid: the Omnicarb Randomized Clinical Trial: trial of glycemic index, carbohydrate intake, and uric acid. Arthritis Rheumatol 2015;68:1281-9.
38. Beyl RN, Hughes L, Morgan S. Update on importance of diet in gout. Am J Med 2016;129:1153-8.
39. Choi HK, Atkinson K, Karlson EW et al. Alcohol intake and risk of incident gout in men: a prospective study. Lancet 2004;363:1277-81.
