Faldgruber ved tolkning af information om bivirkninger i lægemiddelreklamer
Artikel fra Rationel Farmakoterapi 9, 2017
Af: Maija Bruun Haastrup, Afdeling for Klinisk Biokemi og Farmakologi, Odense Universitetshospital
Jesper Hallas, Institut for Sundhedstjenesteforskning, Klinisk farmakologi og farmaci, Syddansk Universitet
Som læge er man jævnligt eksponeret for lægemiddelreklamer. I reklamerne vil producenten ofte fremstille data om bivirkninger af lægemidlet i et så positivt lys som muligt. Selv om argumentationen er faktuelt korrekt, kan den i nogle tilfælde have karakter af manipulation, som kan være vanskelig at gennemskue. Vi vil her give nogle eksempler på sådanne faldgruber, som vi har observeret ved konsulentbesøg eller set i litteraturen. Vi har intet ønske om at hænge nogen ud og tager derfor udgangspunkt i et fiktivt nyt NSAID, xbrufen, som er omkring ti gange så dyrt som ibuprofen, men ifølge producenten giver færre mavesårskomplikationer.
Studier med utilstrækkelig statistisk styrke
»Ved et dobbeltblindt placebokontrolleret forsøg med xbrufen inkluderende over 2.500 deltagere i tre måneder finder man en hyppighed af alvorlige mavesårsblødninger på niveau med placebo. Alle andre NSAID har en veldokumenteret risiko for at fremkalde mavesårsblødninger.«
Normalt har man ingen interesse i at argumentere ud fra studier med utilstrækkelig statistisk styrke, dvs. at studiet er dimensioneret for småt, således at der på trods af klinisk betydende forskelle mellem præparaterne eller over for placebo ikke opnås statistisk signifikans. Producenterne vil gerne kunne argumentere for, at deres produkt er signifikant bedre end placebo eller relevante komparatorer til at opnå den intenderede effekt af lægemidlet, fx smertelindring, blodtrykssænkning eller bedring af lipidprofil. Men med bivirkninger kan det forholde sig omvendt; såfremt studiet har utilstrækkelig statistisk styrke til at påvise bivirkninger, vil man være ude af stand til at påvise, at lægemidlet er værre end placebo, og det kan vendes til en fordel.
I dette fiktive eksempel mangler studiet klart statistisk styrke. Incidensen af alvorlig mavesårsblødning er omkring 60 per 100.000 per år [1], svarende til ca. 3.500 tilfælde årligt i Danmark, hvoraf ca. 40%, eller 1.400 tilfælde er brugere af NSAID på blødningstidspunktet [1]. Til sammenligning er der i Danmark omkring 800.000 brugere af receptindløst NSAID hvert år [2], og dermed vil kun 1,75 ud af 1.000 NSAID-brugere inden for et år opleve en alvorlig blødning. Med 2.500 patienter inkluderet i dette studie, hvoraf halvdelen får xbrufen, vil kun 1-2 forventes at få en mavesårsblødning. Selv om de skulle falde i xbrufengruppen, vil det ikke opnå statistisk signifikans, og producenten vil konkludere, at der er alvorlige bivirkninger på niveau med placebo.
Brug af surrogatmål
»Ved en stor dobbeltblind klinisk afprøvning af xbrufen mod ibuprofen fandtes gastritisforandringer hos 30% af xbrufenbrugerne mod 50% af ibuprofenbrugerne (p < 0,05). Den gastrointestinale mikroblødning var henholdsvis 2,2 og 4,9 g hæmoglobin/dag (p < 0,01).«
Surrogatmål som outcome benyttes i mange studier i stedet for hårde endemål. Dette kan være velbegrundet, eksempelvis hvor det ikke er muligt at afvente hårde endemål som død. Imidlertid rummer surrogatmål den faldgrube, at man ekstrapolerer fra noget målbart til noget mindre målbart og/eller sjældnere forekommende. Hvis dette skal give mening, skal der være en relation mellem surrogatmålet og det egentlige endemål, hvad der i en del tilfælde ikke er. Velkendte eksempler på brug af surrogatmål er sænkning af HbA1c ved behandling af type 2-diabetes eller blodtrykssænkning hos patienter med forhøjet blodtryk. Begge mål virker umiddelbart klinisk oplagte, men i virkeligheden er vi som læger og vore patienter jo mere interesserede i, om en sænkning af blodsukkeret eller blodtrykket udskyder komplikationer til grundsygdommen eller i sidste ende døden.
I eksemplet nævnes surrogatmålene gastritisforandringer og mikroblødning. Det første vil skulle diagnosticeres ved endoskopi, og selv om omkring 30% af patienter i langtidsbehandling med NSAID udvikler endoskopisk verificerbare ventrikelulcerationer, er der kun ringe korrelation mellem patienternes symptomer og endoskopifund [3]. Mikroblødning har ligeledes heller ikke den store kliniske betydning. Det, som bør have patienternes og lægernes interesse i stedet, er klinisk betydende endemål, eksempelvis symptomgivende gastritis, mavesår og klinisk betydende blødning fra gastrointestinalkanalen. Det er dog givet, at hvis det nye lægemiddel havde en bedre risikoprofil i forhold til de hårde endemål end konkurrentens, ville denne pointe have været det primære salgsargument.
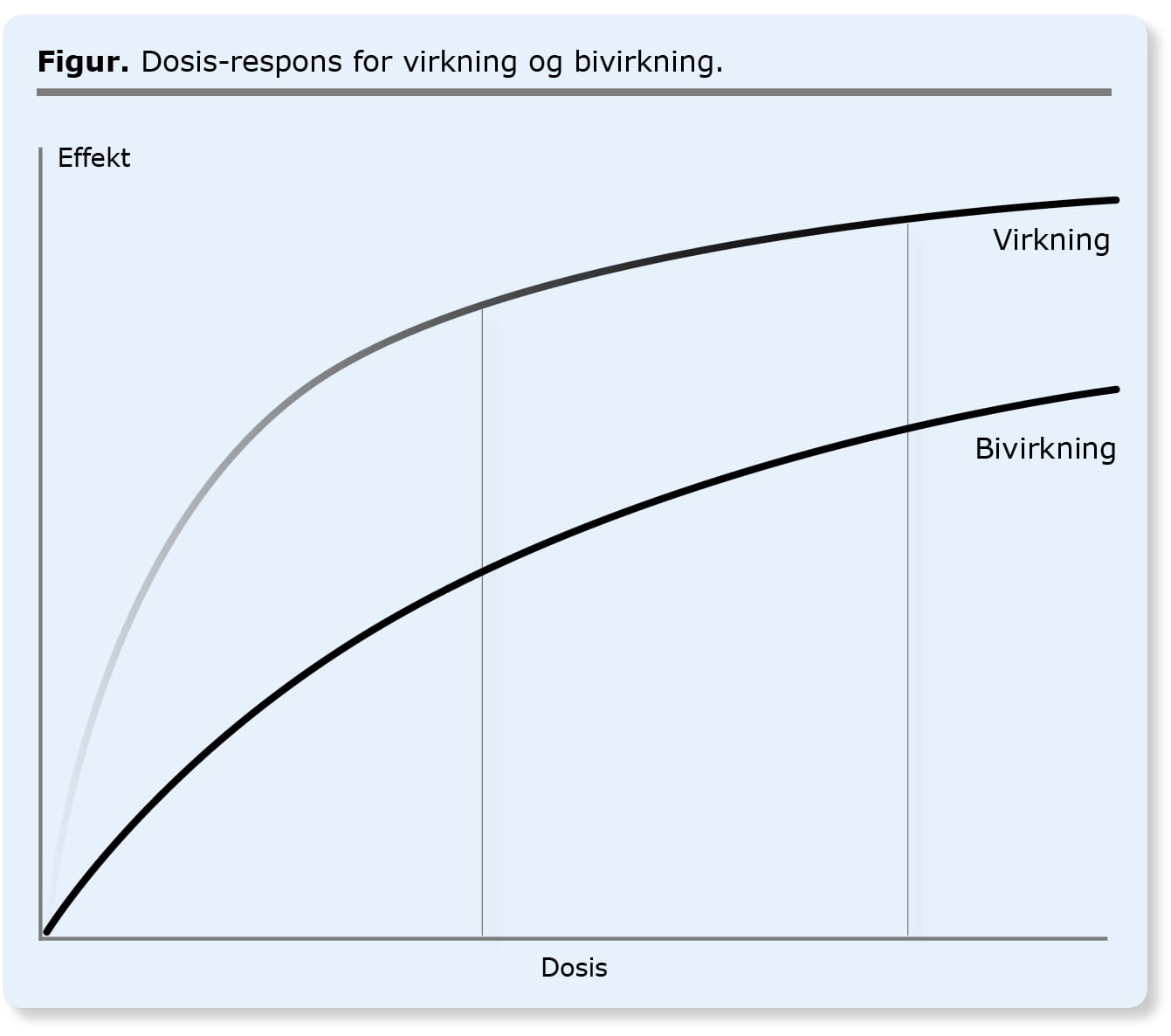
Brug af usammenlignelige doser
»Ved en stor dobbeltblind afprøvning af xbrufen over for ibuprofen finder man en signifikant nedsat risiko for mavesårsblødning for xbrufen, men samme gavnlige effekt på ledsmerter.«
Det lyder umiddelbart besnærende; færre bivirkninger og samme lægemiddelgavn. Her er det dog væsentligt at være opmærksom på, hvilke doser der er sammenlignet. Resultatet vil fx kunne opnås ved at bruge særligt høje doser ibuprofen, fx 800 mg x 3, sammenlignet med standarddoser xbrufen. Det kan forklares ved at dosis-respons-kurverne for gavnlige virkninger og bivirkninger ikke har samme form. I det konkrete tilfælde med højdosisibuprofen er der mætning ved almindeligt brugte doser, fx 400 mg x 3, og en yderligere øgning vil ikke give større smertelindring. Derimod er der ikke mætning, hvad angår risikoen for mavesårskomplikationer, og den høje dosis ibuprofen vil derfor give flere mavesårskomplikationer end xbrufen, hvis dette gives i standarddosis (se figur).
Brug af relative frem for absolutte risici
»Ved en stor dobbeltblind klinisk afprøvning af xbrufen mod ibuprofen i sammenlignelige doser fandtes færre alvorlige ventrikelblødninger hos xbrufenbrugere end hos ibuprofenbrugere (OR = 0,5 (CI 0,3-0,8)). Derfor bør man rutinemæssigt bruge xbrufen.«
Her ses en anden klassiker i forhold til præsentation af data, der kan lede til overestimering af en sammenhæng, nemlig det relative risikoestimat. Umiddelbart ser resultatet meget tilforladeligt ud, og hvem vil ikke gerne have en halvering af risikoen for alvorlige ventrikelblødninger under brug af NSAID? Det, som gemmer sig bag tallene, er imidlertid, at den absolutte risiko for alvorlige ventrikelblødninger ved brug af NSAID ikke er ret høj. Med den absolutte risiko forstås således, hvor mange patienter i absolutte tal per fx 1.000, der ville opleve bivirkningen, hvis de alle blev behandlet med NSAID. Dvs. at en halvering af denne risiko bliver beskeden og berettiger måske ikke, at man forsøger at sælge lægemidlet med dette som argument. Den relative risiko (RR) og dertil hørende relative risikoreduktion (RRR) benyttes flittigt i studier og salgsmateriale om nye lægemidler. Som det også blev gennemgået i en tidligere artikel i Rationel Farmakoterapi »Læger og tolkning af statistiske oplysninger« fra 2011 [4], vil disse effektmål have tendens til at oversælge budskabet til klinikerne. Intuitivt vil man tænke, at der er tale om en stor effekt, når et lægemiddel er vist kun at have den halve risiko for en alvorlig bivirkning sammenlignet med et andet, men den kliniske betydning af dette fremgår ikke altid. Man bør altid ved læsning af sådanne tal kigge efter den absolutte risiko (AR) og tilhørende absolutte risikoreduktion (ARR), idet disse tal ikke så let misforstås.
I dette sidste eksempel er der en reel om end lille absolut forskel i forekomsten af alvorlige ventrikelblødninger mellem præparaterne. Ofte er nye markedsførte lægemidler dyrere end eksisterende lægemidler, og det er i sidste ende et økonomisk spørgsmål, om den præsenterede gavn er merudgiften værd. En generel brug af præparatet, som producenten lægger op til, er næppe berettiget, men der kan være særlige risikogrupper, hvor det vil være rimeligt.
Konklusion
Ved enhver gennemlæsning af en række faglige tidsskrifter bliver man præsenteret for markedsføringsmateriale for lægemidler. Det er i producentens interesse at fremstille sit præparat i så gunstigt et lys som muligt. Så som udgangspunkt kan man regne med, at man altid bliver udsat for den mest fordelagtige fortolkning af data som muligt. Det er der ikke nødvendigvis noget odiøst i, men man bør som læser – og særligt som læge med ansvar for at udskrive lægemidler til patienter – altid udvise almindelig sund fornuft og skepsis, hvor det er relevant. Hvis noget lyder for godt til at være sandt, er det det nok også.
Korrespondance
Korresponderende forfatter: Maija Bruun Haastrup, mail:mhaastrup@health.sdu.dk
Referencer
- Hallas J, Dall M, Andries A, Andersen BS, Aalykke C, Hansen JM, et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006 Oct 7;333(7571):726.
- www.medstat.dk.
- Brøsen K et al. (red.). Basal og klinisk farmakologi, 5. udg. FADL’s Forlag 2014, kap. 50.
- Heebøll-Nielsen NC. Læger og tolkning af statistiske oplysninger. Rationel Farmakoterapi 12, 2011. Institut for Rationel Farmakoterapi, www.irf.dk.