Incruse® (umeclidinium)
Præparatanmeldelse: Endnu en LAMA i flokken - uden væsentlig forbedret behandling af KOL
Endnu en LAMA i flokken - uden væsentlig forbedret behandling af KOL
Konklusion
Incruse® er et nyt inhalationspræparat af typen langtidsvirkende muskarinreceptorantagonist (LAMA), der er godkendt til vedligeholdelsesbehandling af patienter med kronisk obstruktiv lungesygdom (KOL). Behandling doseres en gang pr. døgn, og registreret dosis er 55 mikrogram (µg) umeclidinium pr. døgn.I forhold til placebo har Incruse® en statistisk signifikant og relevant effekt på øgning af lungefunktionen, reduktion af dyspnø samt forbedring af livskvalitet (1). Incruse® er i randomiserede studier fundet sammenlignelig med to andre LAMA-inhalationsmidler. I forhold til andre LAMA-inhalationsmidler vurderes umeclidinium at være ligeværdig mht. effekt (2) og bivirkninger (1).
Incruse® leveres i samme device (Ellipta) som lægemidlerne Anoro® og Relvar®, der tidligere er blevet anmeldt af IRF (3,4). Anoro® kombinerer umeclidinium og det langtidsvirkende beta-2-agonist (LABA) vilanterol (LAMA+LABA). Relvar® kombinerer inhalationssteroidet fluticasonfuroat og vilanterol (ICS+LABA).
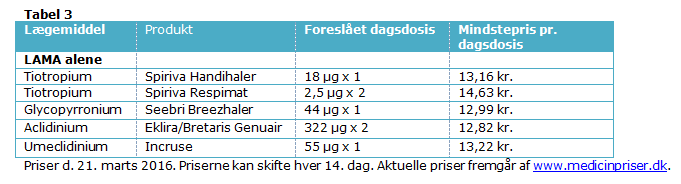
IRF’s samlede vurdering er, at effekten af Incruse® er på linje med andre LAMA’er, men at erfaringsgrundleget for ældre LAMA-præparater, primært tiotropium (5), er betydeligt større. Da der formodentlig er tale om en klasseeffekt indenfor LAMA-gruppen, bør terapivalg bygge på erfaringsgrundlag, håndterbarhed af device samt pris. Incruse® kan være et relevant valg for patienter i triple behandling (ICS/LAMA/LABA), hvor det findes hensigtsmæssigt at bruge så få forskellige devices som muligt. Prisen for Incruse® er i dag på niveau med de andre LAMA-præparater (Tabel 3).
Incruse® blev lanceret september 2015, og der ydes på nuværende tidspunkt generelt tilskud.
Baggrund
Umeclidinium, i Danmark registeret som Incruse®, inhaleres ved hjælp af devicet, Ellipta, som er en pulverinhalator med 30 eller 90 doser. Dosering er én gang dagligt svarende til en dosis af 55 µg.Incruse® er den 4. registrerede langtidsvirkende muskarinreceptorantagonist (LAMA) til symptomlindring hos voksne patienter med kronisk obstruktiv lungesygdom (KOL).
Den primære behandling ved KOL er rygestop. Lungerehabilitering vil også være relevant hos et flertal af patienterne (6-9). Medicinsk behandling af KOL er primært symptomlindrende, og med stigende sværhedsgrad af sygdommen vil der ofte være behov for kombinationsbehandling, mens tillæg af inhalationssteroid vanligt kun er indiceret hos patienter med svær KOL og tendens til eksacerbationer. Forceret ekspiratorisk volumen i det første sekund (FEV1) har tidligere alene været anvendt til vurdering af sværhedsgraden af KOL, men i den seneste tid har man fundet frem til, at sygdomsforløbet hos patienter med KOL ikke alene kan baseres på lungefunktionen, hvorfor stadieinddelingen nu er blevet mere nuanceret. Denne nye stadieinddeling, som er introduceret ved Global Initiative for Chronic Obstructive Lung Disease (GOLD), tager udgangspunkt i sværhedsgraden af luftvejsobstruktionen bedømt ved FEV1, graden af symptomer (vurderet ved Modificeret form af dyspnøskalaen af Medical Recearch Council [mMRC] og KOL assessment test [CAT]) samt antallet af eksacerbationer i det foregående år. Patienter med KOL vil herefter kunne inddeles i stadie A, B, C eller D (10).
Det er veldokumenteret, at LABA eller LAMA bør anbefales som førstevalgsvedligeholdelsesbehandling ved KOL i GOLD stadie B og C (11).
Det er IRF’s generelle anbefaling, at patienter med KOL som udgangspunkt bør behandles i henhold til deres GOLD-gruppe med velkendte lægemidler i det billigste inhalatorsystem og lavest mulige maksimalt symptomlindrende dosis, da der ikke er klinisk relevant forskel på effekten inden for samme stofgruppe i forskellige inhalatorer eller ved brug af flere lægemidler i enkeltstofinhalatorer versus kombinationsinhalator (12).
Effekt
Effekt af Incruse® er undersøgt i flere randomiserede placebokontrollerede studier af 12-24 ugers varighed. Primære endepunkter var i alle effektstudier forbedring i lungefunktion ud fra trough FEV1 (forceret expiratorisk volumen i 1. sekund målt som dalværdi 24 timer efter seneste behandling). Sekundære endepunkter var bl.a. livskvalitet (St George’s Respiratory Questionnaire [SGRQ]) og dyspnø (Transistion Dyspnoea Index [TDI]). Følgende tærskelværdier anvendes ved vurderingen af klinisk relevans: lungefunktionen (∆FEV1 > 100 ml), patientrapporteret dyspnø (TDI ≥ 1 enhed) samt livskvalitet (SGRQ ≥ 4 enheder) (9).Incruse®-behandling er i studierne undersøgt hos KOL-patienter klassificeret som minimum GOLD B. Halvdelen af forsøgspersonerne havde moderat til svær KOL, svarende til GOLD C og D. I alle studierne var det tilladt, at forsøgspersonerne var i fast behandling med inhalationssteroid (ICS).
FEV1:
I et 24 ugers placebokontrolleret studie (13) blev effekt af kombinationsbehandling med umeclidinium og LABA, monoterapi med enten LABA eller umeclidinium og placebo sammenlignet. Sammenlignet med placebo var der ved behandling med umeclidinium 55 µg i monoterapi en klinisk relevant effekt på lungefunktionen (trough FEV1 = 115 ml; 95% sikkerhedsinterval 76 til 155 ml; p< 0.001).
I et 12 ugers studie (14) blev der undersøgt effekt af umeclidinium i monoterapi sammenlignet med placebo. Behandlingsdosis var 55 µg og 110 µg, hvoraf umeclidinium 55 µg kun er registreret i Danmark. Umeclidinium-behandling sammenlignet med placebo havde forbedring af trough FEV1:
- umeclidinium 55 µg (127 ml; 95% sikkerhedsinterval: 52 til 202 ml)
- umeclidinium 110 µg (152 ml; 95% sikkerhedsinterval: 76 til 229 ml)
Tillæg af umeclidinium til LABA og ICS er også undersøgt i to 12 ugers placebokontrollerede studier (15), hvor den additive effekt af umeclidinium til igangværende behandling med ICS og LABA gav en statistisk signifikant effekt på trough FEV1 (studie 1: 124 ml [93 til 154 ml]; studie 2: 122 ml [91 til 152 ml]).
I forhold til tillæg af umeclidinium til LABA, henvises til IRF’s præparatanmeldelse af Anoro® (3).
Reduktion af dyspnø (TDI):
I studiet med 24 ugers opfølgning (13) havde alle aktive behandlinger i forhold til placebo en statistisk signifikant forbedring (≥ 1 enhed, p<0001) af TDI-score for dyspnø. Af patienterne der fik 55 µg umeclidinium alene havde 53% forbedring af TDI-score i forhold til 41% på placebo.
I 12 ugers studiet (14), hvor umeclidinium (hhv. 55 µg og 110 µg) blev sammenlignet med placebo, blev der fundet en statistisk signifikant reduktion af dyspnø (TDI-score) for begge behandlinger ved udgangen af 12. uge.
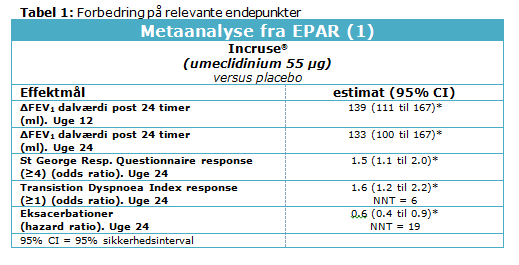
Metaanalysen i godkendelsesrapporten af samtlige 24 ugers studier fandt, at NNT for at forhindre et tilfælde af dyspnø var 6 (Tabel 1).
Forbedring af livskvalitet (SGRQ):
I 24 ugers studiet (13) havde statistisk signifikant flere patienter behandlet med 55 µg umeclidinium en klinisk relevant forbedring (≥4 enheder) af SGRQ sammenlignet med placebo (44 % vs 34 %; p<0.01), hvilket svarer til en NNT på 10 (fra 6 til 31). Metaanalysen i godkendelsesrapporten fandt ligeledes statistisk signifikant effekt (Tabel 1).
KOL-eksacerbation og brug af behovsmedicin:
Der var statistisk signifikant længere tid til første KOL-eksacerbation for patienter behandlet med 55 µg umeclidinium sammenlignet med placebo (hazard ratio: 0,6 (95% sikkerhedsinterval 0,4 til 1,0; p < 0.05) i 24 ugers studiet (13). Metaanalysen i godkendelsesrapporten fandt, at NNT for at forhindre en KOL-eksacerbation var 19 (Tabel 1). Studierne var ikke specifikt designet til at evaluere effekten af behandling på KOL-eksacerbationer, og patienter blev trukket ud af studiet, hvis en eksacerbation opstod. Det til trods kan det ikke udelukkes, at umeclidinium 55 µg har en klinisk relevant forbedring i forhold til at reducere eksacerbation hos patienter med KOL.
Over en 12 ugers observationsperiode (14) var der hos patienter i behandling med umeclidinium 55 µg en signifikant reduktion af behovsmedicin sammenlignet med placebo (gennemsnitlig reduktion 0,7 pust pr. dag; 95% sikkerhedsinterval -1,3 til -0,1 p=0.025). Dette blev overraskende ikke påvist hos patienter i behandling med umeclidinium 110 µg (0,6 inhalation pr. dag; 95% sikkerhedsinterval -1,2 til 0,0 p=0.069). Ligeledes blev der i 24 ugers studiet ikke fundet en statistisk signifikant reduktion af behovsmedicin (gennemsnitlig reduktion 0,3 pust pr. dag; -0,8 til 0,2) (13). Ved astma anses en forskel på 0,8 pust per dag for klinisk relevant (16). Det er derfor usikkert, om umeclidinium 55 µg giver en relevant forbedring i forbruget af behovsmedicin.
Umeclidinium 55 µg er i to randomiserede korttidsstudier (12 uger) blevet sammenlignet med henholdsvis glycopyrronium 44 µg og tiotropium 18 µg, hvor umeclidinium ikke blev fundet klinisk relevant dårligere end de to andre LAMA-præparater (17,18). I studiet, hvor umeclidinium blev sammenlignet med tiotropium (18), blev der fundet en statistisk signifikant, men ikke kliniske relevant, forbedring i FEV1 (trough FEV1 = 59 ml; 95% sikkerhedsinterval 29 til 88 ml; p< 0.001). Der blev ikke fundet forskel mht. bivirkninger i de to studier.
Bivirkninger
Den overordnede bivirkningsprofil for umeclidinium var generelt sammenlignelig med de øvrige LAMA-præparater. Selv om umeclidinium tilhører en veletableret og kendt klasse af stoffer (LAMA), er umeclidinium dog et nyt aktivt stof, og sikkerhedsdata fra denne klasse er ikke nødvendigvis direkte overførbar (1). Der blev heller ikke fundet forskelle i andelen af bivirkninger ved tillæg af umeclidinium til ICS+LABA sammenlignet med ICS+LABA alene (15).
Tabel 2
Interaktioner
Samtidig behandling med andre antikolinerge præparater anbefales ikke, da der er risiko for at forværre antikolinerge bivirkninger/symptomer.
Pris
Produktresumé
Produktresuméet for Incruse® findes her.Kontakt
Ved spørgsmål eller kommentarer til anmeldelsen kan IRF kontaktes på: irf@sst.dk.Referencer
- EPAR Incruse: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/002809/WC500167431.pdf
- Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Ismaila AS, Huisman EL, Punekar YS, Karabis A. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10:2495-517.
- IRF’s præparatanmeldelser af Anoro, 28/1-2015: http://www.irf.dk/dk/anmeldelser/praeparatanmeldelser/anoro-umeclidinium-vilanterol.htm
- IRF’s præparatanmeldelser af Relvar, 11/7-2014: http://www.irf.dk/dk/anmeldelser/praeparatanmeldelser/arkiv/relvar_ellipta_fluticasonfuroatvilanterol.htm
- Tiotropium versus placebo for chronic obstructive pulmonary disease. Karner C, Chong J, Poole P.Cochrane Database Syst Rev. 2014 Jul 21;7:CD009285.
- Danske KOL-Guidelines. Dansk Lungemedicinsk Selskab. http://www.lungemedicin.dk/fagligt/101-dansk-kol-retningslinje-2012/file.html
- National Institute for Clinical Excellence (NICE): Chronic obstructive pulmonary disease (COPD): management of chronic obstructive pulmonary disease in primary and secondary care. 2010. http://www.nice.org.uk/nicemedia/live/13029/49399/49399.pdf
- National klinisk retningslinje: Rehabilitering af KOL-patienter. Sundhedsstyrelsen 2014. https://sundhedsstyrelsen.dk/da/udgivelser/2014/~/media/C0B92E9C3BEA4B28A3294D70288EC535.ashx
- Rationel Farmakoterapi, nr. 9, november 2014. http://www.irf.dk/download/rationefarm9_2014.pdf
- From the Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2015. Available from: http://www.goldcopd.org/
- Baggrundsnotat for medicinsk behandling af patienter med KOL. Rådet for Anvendelse af Dyr Sygehusmedicin (RADS) 2015. http://www.regioner.dk/~/media/Mediebibliotek_2011/SUNDHED/Medicin/R%C3%A5det%20for%20Anvendelse%20af%20Dyr%20Sygehusmedicin/KOL%20Baggrundsnotat%20inkl%20bilag%20juni%202015.ashx
- Godt nyt for patienter med obstruktive lungelidelser, IRF, 2012. http://www.irf.dk/dk/aendrede_retningslinjer/godt_nyt_til_patienter_med_obstruktive_lungelidelser.htm
- Efficacy and safety of once-daily umeclidinium/vilanterol 62.5/25 mcg in COPD. Donohue JF, Maleki-Yazdi MR, Kilbride S, Mehta R, Kalberg C, Church A. Respir Med. 2013 Oct;107(10):1538-46.
- Umeclidinium in patients with COPD: a randomised, placebo-controlled study. Trivedi et al. Eur Respir J 2014; 43: 72–81
- Efficacy and safety of umeclidinium added to fluticasone furoate/vilanterol in chronic obstructive pulmonary disease: Results of two randomized studies. Siler TM et al .Respir Med. 2015 Sep;109(9):1155-63
- Santanello NC, Zhang J, Seidenberg B, Reiss TF, Barber BL. What are minimal important changes for asthma measures in a clinical trial? Eur Respir J 1999; 14: 23-7
- A randomised, open-label study of umeclidinium versus glycopyrronium in patients with COPD. Rheault T., et al. ERJ Open Research Apr 2016, 2 (2).
- A randomized, blinded study to evaluate the efficacy and safety of umeclidinium 62.5 μg compared with tiotropium 18 μg in patients with COPD. Feldman G., et al. Int J Chron Obstruct Pulmon Dis. 2016 Apr 7;11:719-30.